Cell | 深圳先进院甘海云团队揭示ecDNA维持的关键机制
染色体外DNA(extrachromosomal DNA,ecDNA)是一种独立于染色体存在的环状DNA分子,在30-50%的恶性肿瘤患者中被检测到。尽管早在1965年研究人员就在神经母细胞瘤中观察到其存在(当时称为双微体),但受限于技术手段,其存在的生物学意义长期未被阐明。研究发现,ecDNA可携带完整的致癌基因(如MYC、EGFR)及其增强子序列。当这些基因从染色体脱落并环化形成ecDNA后,原本的表观遗传修饰(如DNA甲基化和组蛋白修饰)记忆丢失,导致癌基因的异常激活(图1)。
临床证据表明,携带ecDNA的肿瘤患者往往表现出更高的恶性程度、更强的治疗抵抗和更差的临床预后。因此,靶向ecDNA的抗肿瘤策略(如干扰其复制与维持、调控表观遗传重塑)具有重要治疗潜力。然而,ecDNA的复制与维持机制、表观遗传重塑及其在肿瘤发生发展中的精确作用,仍是当前研究的核心挑战。解决这些问题将为开发新型抗癌疗法提供关键突破口。
4月28日,中国科学院深圳先进技术研究院定量合成生物学全国重点实验室、合成生物学研究所研究员甘海云团队在学术期刊Cell上发表题为“Extrachromosomal DNA replication and maintenance couple with DNA damage pathway in tumors”的研究论文,揭示了ecDNA维持与DNA损伤应答之间的双向调控关系,为理解ecDNA在肿瘤发生发展中的作用机制提供了新视角,也为开发靶向ecDNA的抗肿瘤治疗策略奠定了重要理论基础。这一突破性发现为解决上述核心挑战提供了关键科学依据。

文章上线截图
原文链接: https://doi.org/10.1016/j.cell.2025.04.012
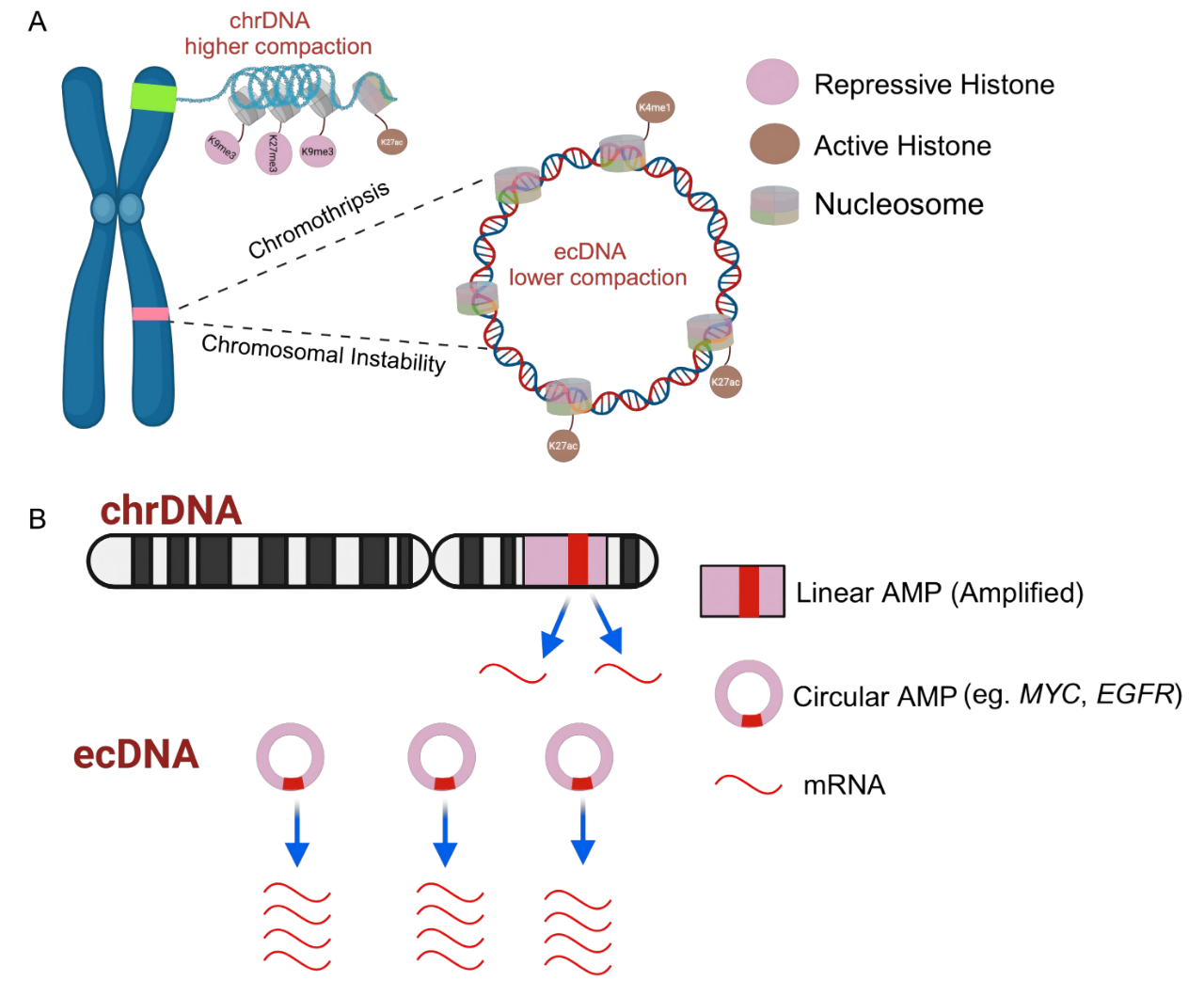
图1 ecDNA上抑制性组蛋白丢失,致癌基因表达增加
为突破ecDNA复制与维持机制研究的瓶颈,研究团队采用CRISPR-Cas9基因编辑技术,成功构建了稳定携带EGFR基因完整拷贝的ecDNA细胞系,以及创新性地结合体外人工染色体组装技术,构建了模拟临床患者来源的人工ecDNA分子。解决了该领域长期存在的关键难题--缺乏严格匹配的ecDNA阳性/阴性对照细胞模型。通过用核苷类似物5-乙炔基-2’脱氧尿嘧啶核苷(EdU)处理上述基因工程细胞系及其他多种ecDNA肿瘤模型,研究人员获得了ecDNA在活细胞内进行自主复制的直接证据(图2)。

图2 人工产生ecDNA在胞内稳定存在并自主复制
为了深入解析ecDNA的复制与维持机制,研究团队进一步采用改进的新生链蛋白质富集技术,系统鉴定了与ecDNA复制相关的蛋白质组。分析结果显示,在携带ecDNA的细胞中,DNA复制核心机器(如MCM复合物)和表观遗传调控因子(包括组蛋白修饰酶和染色质重塑复合物)显著富集于新生DNA链上。值得注意的是,研究意外发现DNA损伤应答相关蛋白在ecDNA复制位点呈现异常高水平的富集。通过一系列严谨的功能实验,研究团队证实:与对照组相比,携带ecDNA的细胞表现出更严重的基因组不稳定特征,特别是DNA双链断裂(DSB)水平显著升高。进一步实验证明,ATM激酶介导的DNA损伤应答通路在ecDNA阳性细胞中被特异性激活。这些发现揭示了ecDNA复制过程中存在独特的分子特征:一方面需要表观遗传因子的精细调控,另一方面又不可避免地引发DNA损伤修复通路的激活。
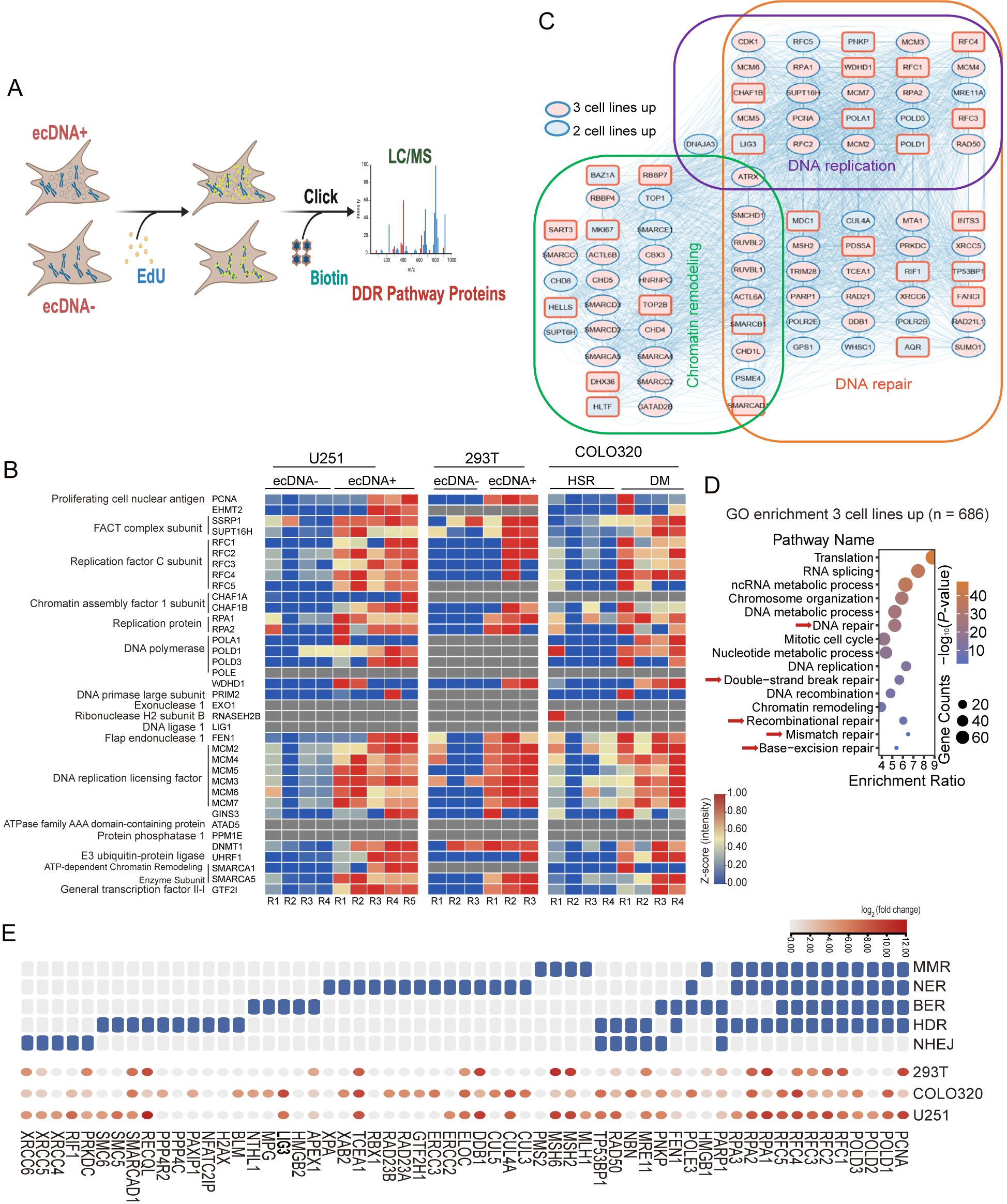
图3 利用人工染色体等系统鉴定到ecDNA表观调控因子
基于ecDNA松散的染色质结构特征,研究团队提出假说:ecDNA在细胞周期动态变化过程中可能成为基因组不稳定的重要来源。通过多维度实验验证,研究人员发现ecDNA细胞中异常升高的DNA损伤水平主要源于两个关键生物学过程:ecDNA的异常活跃复制和转录。这些过程显著激活了ATM介导的DNA损伤应答(DDR)通路。在分子机制层面,研究揭示了ecDNA上存在独特的拓扑异构酶切割复合物(TOPCC)异常积累现象。这是由于ecDNA上高密度的复制/转录复合体与TOPCC发生持续性冲突所致,这种冲突最终导致DNA双链断裂(DSB)的累积。
值得注意的是,研究人员发现ecDNA的稳定维持高度依赖特定的DNA损伤修复途径。通过系统性筛选,研究团队采用基因敲低和小分子抑制等手段,对同源重组修复(HR)、经典非同源末端连接(NHEJ)和替代性非同源末端连接(alt-NHEJ)三条主要修复通路进行了功能分析。令人意外的是,单独或同时阻断HR和NHEJ通路对ecDNA水平影响有限,而特异性抑制alt-NHEJ则能显著降低细胞内ecDNA的丰度(图4)。深入机制研究表明,alt-NHEJ的缺失会在细胞周期特定阶段阻碍DSB修复,进而影响ecDNA的环化过程。这导致ecDNA要么重新整合回染色体,要么被细胞清除。这一发现不仅阐明了ecDNA维持的核心分子机制,也为靶向ecDNA的抗肿瘤治疗提供了新的策略方向:特异性干扰alt-NHEJ通路可能成为选择性清除肿瘤细胞中ecDNA的有效手段。

图4 ecDNA激活DNA损伤并通过alt-NHEJ方式修复
患者临床数据表明,降低细胞内ecDNA含量可能有助于肿瘤的治疗。本研究发现DDR尤其是alt-NHEJ参与了ecDNA含量的维持,并解析了其可能的机制。接着研究团队探讨了基于这些研究成果来治疗肿瘤的可行性,发现使用携带ecDNA的细胞对DDR关键因子如ATM、CHK、TOP1等抑制剂更加敏感,这些抑制剂能够显著降低细胞内ecDNA的含量,有效杀伤携带ecDNA的细胞(图5)。这一重大突破指出,靶向ecDNA维持过程很有可能成为携带ecDNA肿瘤的通用治疗手段。

图5 ecDNA的维持机制与潜在治疗策略探索
本研究系统阐明了肿瘤细胞中ecDNA的独特生物学特性:其固有的不稳定性与DNA损伤应答(DDR)通路介导的稳定性之间形成了动态平衡体系。这一突破性发现揭示了ecDNA通过平衡态调控参与肿瘤发生发展的分子机制,为临床转化提供了新靶点——基于ecDNA分子特征开发的靶向药物或将成为30-50% ecDNA阳性肿瘤患者的精准治疗选择。
值得关注的是,本研究揭示的环状DNA复制维持机制可能拓展了肿瘤生物学的认知边界。例如,研究提示HPV等DNA病毒在宿主细胞内的复制过程可能同样依赖于类似的DDR通路调控模式,该发现不仅为病原体环状DNA复制机制研究开辟了新方向,更为抗病毒治疗策略的研发提供了重要理论依据。
中国科学院深圳先进技术研究院研究员甘海云为论文的唯一通讯作者。助理研究员康星、周嘉琦、田聪聪、张洋、邱玲瑜,博士生李欣然、深圳大学博士生邓志文为论文的共同第一作者。深圳大学刘向宇、朱骞教授在本研究中给予了大力支持和提出了宝贵意见。该工作获得了国家合成生物学重点研发计划,国家自然科学基金重大项目及深圳合成生物创新研究院等项目的支持。
PI及课题组简介
甘海云博士,中国科学院深圳先进技术研究院合成生物学研究所研究员,博士生导师。近年来研究成果发表在Cell、Science、Nature Medicine、Nature Genetics、Molecular Cell、Nature Communications、Genes & Development、PNAS、eLife、The EMBO Journal、Nucleic Acids Research等知名期刊,累计引用超过3900次。
课题组主要研究方向为利用系统生物学、合成生物学以“干湿”实验结合的模式研究表观基因组信息的传递机制以及其在肿瘤发生和耐药性产生、全能性细胞(2C)、细胞衰老、染色体外DNA(ecDNA)、合成表观重构、DNA复制起始分子复合物、人工细胞等的表观遗传调控机制。
课题组现招聘有表观基因组学、合成生物学、生物信息学、肿瘤生物学、细胞生物学等任一相关研究背景博士后1-2名,研究助理1-2名,欢迎志同道合的朋友投送简历至hy.gan@siat.ac.cn,简历及邮件标题注明“应聘岗位-学校名称-专业-姓名”。
